对话君实生物CEO邹建军:成熟的Pharma需要研发、商业双驱动
从2015年中国药审改革算起,国内创新药产业已经走过10年的“黄金时期”。最早一批生物科技公司过得怎么样?是否踩准了市场变化的每一个鼓点?
君实生物(688180.SH)可能是最适合回答这个问题的公司之一。它是首个国产PD-1药物的拥有者,第一批在海外建立研发中心的中国公司,三年内实现了两款抗新冠新药的商业化;但同时,它也经历了从Biotech(生物科技公司,以研发为主)到Pharma(生物制药公司,集研、产、销于一体)的商业化阵痛。
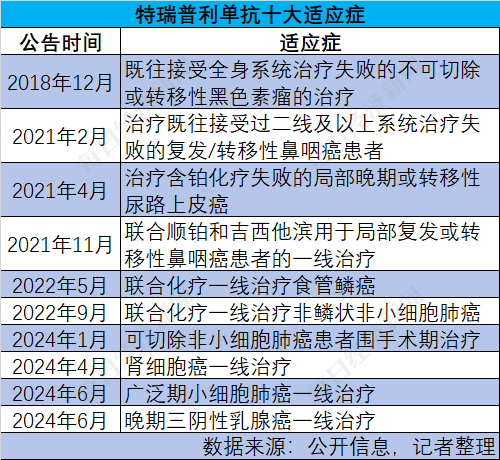
2024年是君实生物成立第12年,也是公司改革成效初现的一年。今年前三季度,公司实现营业收入12.71亿元,同比增长28.87%,归母净利润为-9.27亿元,亏损同比缩窄34.12%。特瑞普利单抗(商品名:拓益)的10项获批适应症中,有4项都是今年官宣,获批国家/地区新增了30多个。
变化从来不是突然发生的。在投融资市场低迷时,中国创新药企业如何养精蓄锐?11月中旬,《每日经济新闻》记者对话君实生物总经理兼首席执行官(CEO)邹建军,她认为,成熟的Pharma需要研发、商业双驱动。

在资本寒冬中学做减法,加强自身“造血”能力
2024年,“创新药”首次出现在政府工作报告中,被列为积极培育的新兴产业之一。7月5日,国务院常务会议审议通过《全链条支持创新药发展实施方案》,更让低迷许久的资本市场为之一振。
据邹建军观察,近年来随着宏观环境的变化,医药行业的监管力度逐渐加大,技术和人才的流动也让市场竞争越发激烈,上市监管和资本退出机制的变化都使整个行业的投融资相对收缩,资本对创新药赛道以及医药行业的布局趋向谨慎,更愿意倾向有着差异化优势和真正具备“硬科技”实力的产品或公司。
“面对市场的不断变化和挑战,我们也必须积极寻求变革以适应新的发展需求。”邹建军所说的变革之一,是今年开启的“提质增效重回报”行动。公司的研发费用从2022年的23.84亿元降到2023年的不到20亿元。今年前三季度,公司研发费用为8.74亿元。
邹建军表示,研发费用减少主要是随着核心产品拓益的多项注册临床试验达到主要研究终点,公司优化资源配置,集中聚焦在更有优势的管线上,同时提升临床执行效率,公司临床、技术服务费及职工薪酬有所减少。
与此同时,君实生物在商业化方面投入了更多的精力。过去几年,君实生物的销售口负责人可能是变动最多的岗位之一。今年10月,公司营销事业部总经理王行远晋升为首席商务官,Mehul Shah博士则被任命为商务拓展副总裁,负责商务拓展部,其中前者曾负责过包括另一款国产PD-1药物卡瑞利珠单抗在内的多个创新药的全国销售工作并取得了优异的业绩,后者则推进过BMS在肿瘤学、血液学和细胞治疗方面的几项战略交易。2024年前三季度,君实生物实现营收12.71亿元,同比增长约29%,其中核心产品PD-1药物特瑞普利单抗于国内市场实现销售收入10.68亿元,同比增长约60%。
“一家成熟的全产业链Pharma一定是研发、商业的双驱动。”邹建军告诉记者,公司今年进行了一些组织架构的调整,而特瑞普利单抗的营收增长将加快公司自身“造血”能力的提升,是公司未来资金来源的重要组成部分,其余获取现金流的方式还包括探索潜在BD(商务拓展)合作,丰富融资手段,和适宜、合理、合规地借助银行授信或资本运作。
在邹建军看来,面对行业背景和估值的变化,创新药企业应该围绕经营、筹资及投资活动对现金流进行统筹和管理,丰富现金来源和更有效地使用现金。目前,公司拥有33.12亿元的资金储备,将为后续几个Ⅲ期临床管线的商业化兑现提供坚实支持。

创新药企商业化承压,找国际化伙伴“合适最关键”
从“肿瘤神药”PD-1,到“生物导弹”ADC,再到抗体药物的“ProMax”双抗,行业热点总是轮动出现,创新药企业的每次立项都像押宝,现在,君实生物的多款在研管线已经到了“开宝”阶段。
据邹建军介绍,特瑞普利单抗目前已在中国实现“十全实美”,累计获批10项适应症,还有一线治疗黑色素瘤、联合贝伐珠单抗一线治疗晚期肝细胞癌的2项新适应症上市申请已获得NMPA(国家药品监督管理局)受理。今年10月刚获批的第5款商业化产品昂戈瑞西单抗(商品名:君适达)还有两项高脂血症相关的适应症正在上市审评中。
另外,公司潜在First-in-Class(同类首个)产品抗BTLA单抗tifcemalimab已进入Ⅲ期临床阶段,两项注册Ⅲ期临床研究中,一个是国际多中心的小细胞肺癌Ⅲ期研究,正在中、美、欧、日等地持续入组中,另一个是在国内开展的针对经典型霍奇金淋巴瘤的Ⅲ期临床研究,目前也在入组中。
而在更早期阶段,公司还“押宝”了Claudin18.2 ADC药物(代号:JS107)、PI3K-a口服小分子抑制剂(代号:JS105)、CD20/CD3双特异性抗体(代号:JS203)、PD-1/VEGF双特异性抗体(代号:JS207)、抗DKK1单抗(代号:JS015)等。
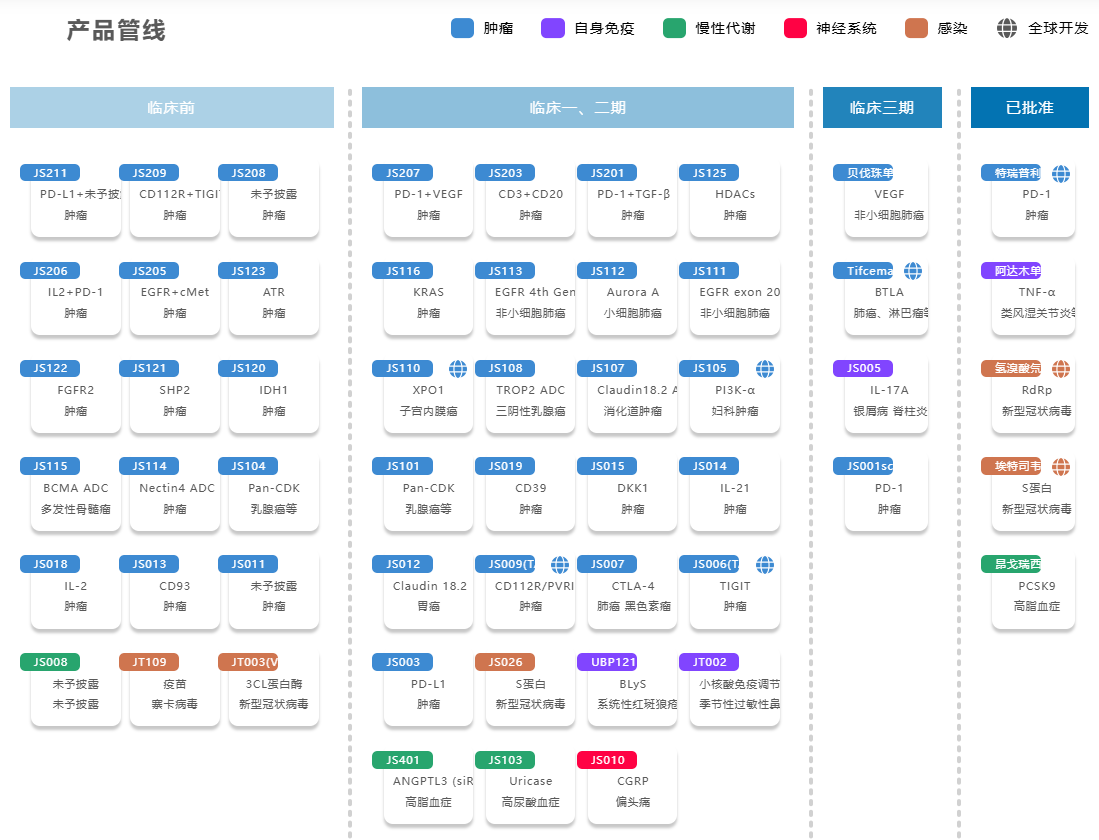
尽管公司的研发布局重视中国患者的需求,但邹建军强调,一家优秀的创新药企应该以全球市场作为目标,以打造First-in-Class、Best-in-Class(同类产品中最佳)药物为突破点,用真正的新产品普惠全球患者。
从主力产品看,特瑞普利单抗今年在国内获批的肺癌、乳腺癌、肾癌等多项适应症均有较大的患者群体;去年10月获得FDA(美国食品药品监督管理局)批准上市后,成为美国首款且唯一获批用于鼻咽癌治疗的药物,今年又陆续在欧盟、英国、约旦、印度等30多个国家和地区获批,涉及鼻咽癌和食管鳞癌适应症。
“创新药企形成全产业链运营的时间不长,在商业化方面受限于自身经验和外部传统药企的压力,所以不仅要立足国内市场,更需要在国际化道路上走得更快、更迫切一些。”邹建军说。
邹建军还表示,不管企业的规模如何,在出海时都可能出现“水土不服”现象,需要一定时间去积累经验,渐进式出海。邹建军以公司与Coherus BioSciences就拓益在北美地区达成的合作为例,表示通过技术许可推动公司产品出海的模式风险较小,“出海合作伙伴的选择,规模在其次,合适最关键”。对于君实生物,并不追求“一揽子”把产品交付给某一个合作伙伴就“大功告成”了,而是一直在对不同区域的市场空间和临床需求、准入体系、监管政策差异、支付报销逻辑、专利保护和仿制药追击等多维度因素进行深入研究,合理安排注册顺序,精准选择最合适的合作伙伴,定位最准确的出海路径和组合方式。

创新药的内涵比以前更加丰富,试错投入必不可少
从2015年起,政府发布了一系列对创新药利好的政策以推动创新药企的发展。从临床、申报上市到落地使用的全流程,多种政策共同发力为中国创新药的快速发展营造出良好环境,为创新药发展奠定了基石。
但从行业层面看,创新药行业监管不断趋严,控费降价合规的主线要求,让今天的创新药企业竞争更为激烈。邹建军表示,在当前背景下,具有差异化和突破性创新价值的产品,可能将是创新药行业新的增长点,影响行业整体向高技术壁垒的新兴创新药种类发展。
具体来说,部分药企会通过暂停部分不占优势的管线,合理控制研发费用的支出,专注于内部开发管线中有潜力、具有临床价值的药物的方式更好地降本增效,还包括产品出海、对外授权、兼并收购等方式,寻求可持续且有差异化竞争优势的发展空间。
即便前行的阻力更大了,但研发效率依旧是中国创新药行业最大的竞争优势。从研发投入看,由于中国研发成本控制全球领先,并且拥有庞大的患者资源,中国新药的研发费用低于欧美市场。例如,中国获批上市的新药研发费用中值约为1亿元人民币,而欧美部分肿瘤新药的研发费用中值高达5亿美元。
这解释了中国创新药企业为何主要以跟随式创新为主,但也对行业生态提出了更高要求。邹建军认为,相比于早年的发展状态,当下的创新药具备一些新的内涵,具体包括全球视野、科技融合、精准医疗、可持续发展、全链条创新和社会价值等。
而对于国内更具竞争力,且志在成为MNC(跨国企业)的头部企业,可能需具备三大特点:即掌握和勇于投入真正First-in-Class药物研发;拥有极致研发效率,能够做到全球靶点研发进度前列;利用成本效益建立深入的疾病和临床见解。
“以上优势均需要大量的金钱和时间及试错的投入。”邹建军提醒,这可能需要市场多些耐心,而这或许也是现在的市场所缺乏的。
免责声明:本文章由“知识和经验”发布如果文章侵权,请联系我们处理,本站仅提供信息存储空间服务如因作品内容、版权和其他问题请于本站联系
